2021年以来,MRD渐成风口,国内大小企业争相入局。作为肿瘤预后管理的刚需产品,市场对MRD检测抱有很高的期待,期待着它能否先早筛一步,成为基因检测玩家的增长引擎。
赛道愈加火热的同时,投资者的辨别难度却越来越大:从技术到出海,MRD大小玩家都在强调自己是赛道领先者。
一个不可忽略的现实是,MRD检测领域火爆归火爆,现在谈“领先”还为时尚早。基于NGS的血液瘤MRD检测产品,才刚刚起步;实体瘤MRD检测产品,更是有待攻克。
不过,一切事物的发展,总是有迹可循。如何才能辨别谁是真正的实力玩家,判断MRD市场的中局乃至终局?基因检测公司的合作伙伴阵容,为我们提供了一个不错的观察窗口。
/ 01 /评价MRD玩家实力的一个维度:合作伙伴的数量和质量
当前,虽然各家公司都表示自己技术实力突出,但由于MRD产品还处于研发早期阶段,性能标准并不统一。因此,技术优劣、性能高下,很难简单做出判断。
而基因检测公司MRD产品合作伙伴的阵容,则是衡量MRD玩家实力的一个重要维度。原因在于,随着NGS测序技术带来的改变,血液瘤MRD检测产品在临床试验中的应用已经相当广泛。
当前,药企血液瘤药物的临床试验中,往往会涉及MRD检测。比如,天境生物的核心产品CD47单抗TJ011133,在国内开展的联合阿扎胞苷治疗急性髓系白血病,或骨髓增生异常综合征的I/IIa期临床研究中,便明确表示探索骨髓MRD与预后的相关性。

在药企需求已经爆发的当下,必然已经有基因检测玩家,成为药企的上游供应商。那么,作为MRD检测产品消费者的药企,最核心的需求是什么?答案是:优异的检测性能、良好的实验室资质。前者直接影响临床试验结果;后者一方面决定了临床试验是否能满足境内、境外合规性要求,另一方面反映了实验室的综合管理能力和质量水平,是检测性能稳定性、检测数据准确性的底层保障。
国际上含金量较高的医学实验室认可体系包括CAP、CLIA、ISO15189认证,目前中国国内已经有一小部分NGS医学检验实验室同时具备了此三项认证。
与此同时,为保障临床试验顺利开展,在合作开展初期药企通常会针对MRD检测合作伙伴的质量管理体系进行严格稽查。由此,通过公司已达成合作的药企数量,我们可以一窥MRD赛道玩家的综合实力。
除了数量,基因检测公司MRD产品合作伙伴的质量也很重要。毕竟,合作伙伴是跨国顶尖药企,还是国内不知名的初创型创新药企,含金量是有差别的。数量与质量并重,无疑是最理想的状态。
/ 02 /科技部官网告诉你:谁才是实力玩家
一个现实的问题是,如何找到基因检测玩家MRD产品合作伙伴的情况?答案是,科技部政务服务平台。
中国人类遗传资源具有重要的战略意义,因此涉及到基因检测相关的业务,都需要审批或者备案。只有审批通过或者备案完成,才能进行临床试验。
而无论是审批还是备案,两者都有公示环节,在科技部网站都可以查询到结果。通过科技部网站,便能找到相关数据,为研究提供一定的支撑。
之所以说是支撑,是因为在研究过程中还要借助海内外临床试验公示平台,进行验证。因为科技部服务平台公布的数据,仅有该临床试验的第三方实验室名单,没有具体的检测项目,无论伴随诊断还是MRD检测,都会归在其中。如下图所示,单看这一临床审批,并不清楚检测项目的具体类别。
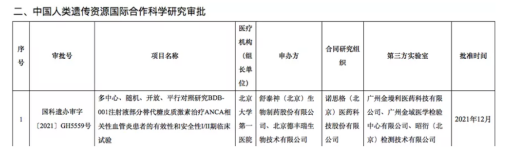
临床试验公示平台则相反:往往只公布临床检测项目内容,而不公布合作伙伴。两个平台的数据相结合,可以起到“闭环”验证的作用。
比如前文提到的天境生物临床试验。可以看到,金域医学以第三方实验室合作伙伴的身份出现在在科技部的审批结果名单中,结合临床试验所需的检测项目,大致可以判断金域医学是为天境生物提供MRD检测服务。
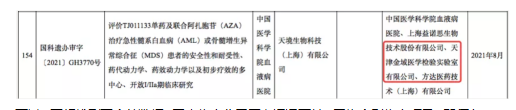
不过,要想找到更全的数据,国内临床公示平台远远不够。因为个别临床项目,即便有MRD检测产品也未必会披露。不少临床试验由海外巨头发起,这些海外巨头在国内披露的临床信息,或许不如海外公示平台详细。如果漏掉这一环,会导致评价维度的不全面。
比如,根据科技部11月份的审批公告,可以看到,辉瑞开展的BCMA双抗三重难治性骨髓瘤临床试验中,第三方实验室中包括泛生子。
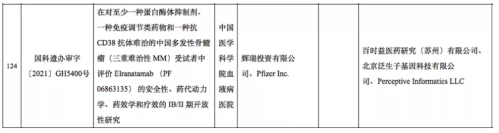
但由于国内临床信息披露有限,无法判断泛生子在该临床中的作用,究竟是基因检测还是MRD检测。这时候,如果能够结合海外临床信息,便可以大致判断,泛生子在该临床中起到的作用是MRD检测。辉瑞在clinicaltrials.gov披露的同适应症临床试验信息中,披露了更详细的次要终点信息,包括“最小残留疾病阴性率”,明确表示需要每12个月评估一次。

考虑到这两个临床进展差异不大,实验设计也基本相同,所以泛生子在上述临床中的作用也就不言而喻了。这个例子说明,尽管略有繁琐,但要想判断MRD玩家的实力,结合海外信息必不可少。上文提及,判断实力玩家的维度,除了合作伙伴数量,还有质量。
仍以泛生子为例,如果没有结合海外信息,根据科技部和国内临床平台披露的信息,得出的结果是,其合作方仅是国内的康方生物、艾欣达伟和明聚生物等玩家。虽然数量不少,但缺少了海外巨头,“质量”维度难免要打折。
对任何一个基因检测玩家来说,能与辉瑞、强生等海外大药厂开展合作,都是其实力的有力佐证。

反过来,对于一些宣称自身技术过硬的基因检测公司,如果通过上述各平台检索下来,并不能看到它们的合作伙伴信息,又或者数量不多、质量不高,那就要斟酌一番了。显然,要想发现真正的实力玩家,需要一双慧眼。
/ 03 /从当下预见未来:谁是最终王者?通过科技部网站发布的信息,我们能够判断谁在血液瘤MRD领域更受药企欢迎不假,借此猜想终局也不难理解。
从目前来看,血液瘤MRD产品会率先发展。而受到药企欢迎的产品,某种程度上也说明其产品具有性能等综合优势。因此,这些产品在血液瘤MRD检测领域脱颖而出,不会让人感到意外。
但这与行业终局,似乎关联不大。毕竟,整个MRD检测市场,前景最大的是实体瘤MRD检测。因为超过90%的肿瘤患者都是实体瘤。
眼下,各家的实体瘤MRD产品基本都还处于更早期阶段。实体瘤MRD产品的检测原理和难度,与血液瘤完全不同。所以,即便某个基因检测玩家的血液瘤MRD产品实力突出,但这与实体瘤领域,并没有必然联系。
听上去没错,但也不完全对。关于这一点,我们需要先明白,实体瘤MRD检测产品的核心竞争力是什么?
答案不难回答:性能突出、便宜好用,当然还有一点,研发进度领先。所有医疗产品的竞争力基本都是这三点,关键在于如何做到。
实体瘤MRD检测产品要做到这三点难度极大,尤其离不开一个关键的角色:数据。
先来看性能。任何一款基因检测产品性能的提升,都需要大量的样本数据来验证。对于实体瘤MRD检测来说更是如此。因为实体瘤治疗后能够释放到血液中的标志物含量非常有限,这就要求检测产品十分灵敏,同时还必须避免过于灵敏把噪音认成信号导致假阳性。只有在大量真实临床数据的支持下,检测算法找到的平衡点才更接近最优解。
再来看研发进度。MRD检测产品,最终需要长期跟踪,明确知道每一个样本患者是否复发,这是一个长周期的过程。即,如果想要快速推进实体瘤MRD检测产品的研发,不仅对一个时间切片上的横向数据有要求,更对长时间尺度的数据积累有明确要求。
最后是成本。实体瘤MRD检测产品成本的下降,更加离不开数据。
实体瘤MRD检测产品研发的难点之一在于,实体瘤突变靶点较多,很难有一款产品可以做到全面筛选。当前的MRD检测产品,主要走高端定制化路线:首先通过WES全外显子检测,去确定肿瘤患者基因突变的靶点,然后再设计相应的产品去持续跟踪。定制化的产品,成本必然不会太低。
而MRD检测产品要想实现价格“亲民”,离不开产品标准化。标准化的关键则在于,找到适应症患者突变位点的共性,尽量排除患者间异质性影响,在可控的成本、有限的检测位点下对患者做到尽量全面的覆盖。实体瘤MRD产品的标准化是否能做好,很大程度上受制于是否有多维度、长时间、大规模的临床数据积累。
综上不难看出,实体瘤MRD检测产品护城河的构建,都指向了“数据”这一关键要素,而这正是药企的核心资产。因此,基因检测玩家要想攻克实体瘤,离不开药企的帮助。从近期公开的泛生子与阿斯利康实体瘤MRD合作来看,其合作重点之一便是利用检测公司的技术与药企的临床样本积累,达到1+1>2的效果。这种模式在未来实体瘤MRD产品开发中可能成为主流。
肿瘤早筛巨头Grail入局MRD领域的标志,便是与安进、阿斯利康以及百时美施贵宝达成战略合作协议。这也进一步证实了,合作伙伴对于MRD玩家的重要性。
对绝大部分基因检测玩家来说,虽然血液瘤的产品性能,不能平移到实体瘤,但依靠血液瘤建立的“朋友圈”的价值是巨大的。
谁能在当下得到更多药企的信赖,意味着在实体瘤MRD检测产品的开发,也能得到更多药企的支持。
这将助力其实体瘤MRD检测产品的开发,使得在整个MRD检测领域的竞争中,更容易构建自身的护城河。